液滴オートファジーの分子メカニズムの解明と医学研究への応用
研究テーマ1:液滴マクロオートファジーと液滴ミクロオートファジーの分子メカニズムの解明
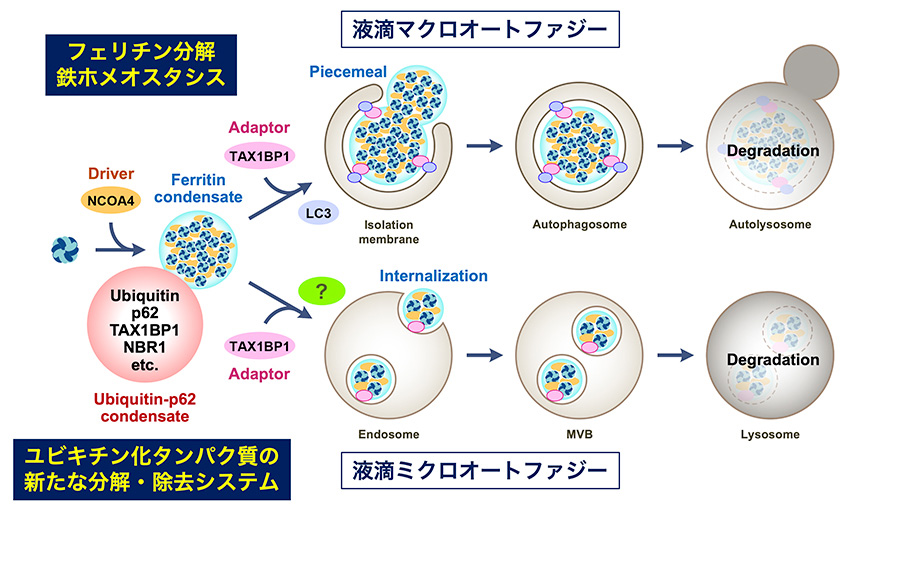
私たちは、鉄貯蔵タンパク質であるフェリチンが液-液相分離によって液滴を形成すること、このフェリチン液滴がマクロオートファジーだけでなく、ミクロオートファジーでも標的化されることを発見し、「液滴ミクロオートファジー」という新たなコンセプトを提案しています。この研究成果は、細胞内の鉄ホメオスタシス研究に新たな知見を与えるとともに、膜伸張を伴うマクロオートファジーと膜陥入を伴うミクロオートファジーで共通する基質標的化メカニズムが存在することを示唆しています。その背景には「液滴」に特有の機能があるものと考えており、従来型のタンパク質-タンパク質相互作用の解析に加えて、液滴形成(高次会合)による弱い相互作用の積算や膜親和性の獲得といった「集合化・メゾスケール化」に伴う新たな機能に着目して研究を進めています。
研究テーマ2:オートファジー活性定量法の開発と応用
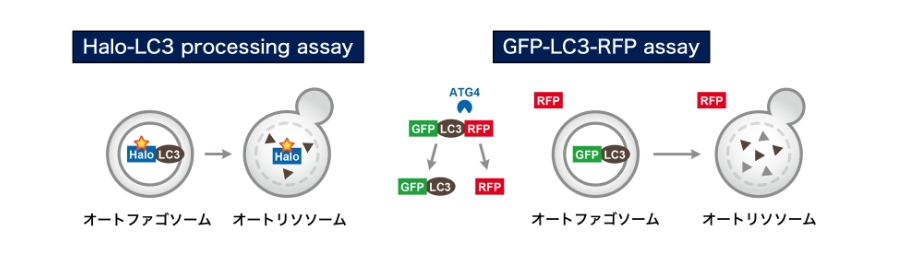
オートファジーの研究には「オートファジー活性の定量」が不可欠です。私たちは、哺乳類細胞で利用可能な高感度オートファジー定量法の開発を行っており、様々なタイプの選択的オートファジーについて個別に高感度定量する技術開発を進めています。また、これらの高感度定量技術に基づいた新たなスクリーニング系の開発を行っており、選択的オートファジーの新たな分子メカニズムの発見と理解を目指します。また、個体レベルでのオートファジー活性定量法の開発や新規オートファジー関連バイオマーカーの探索を試みており、医学研究への応用を視野に入れて研究を進めています。
癌の分子メカニズムの解明から治療法開発への展開
細胞が本来持っている様々な制御メカニズムが破綻することにより細胞は癌化(腫瘍形成)すると考えられており、癌細胞が持つ特徴として以下の10種類が提唱されています。

しかし、腫瘍環境は上述した特徴を複合的に持った様々なタイプの癌細胞やそれを取りまく異なる性質の細胞(癌関連線維芽細胞、免疫細胞など)の集合体であり、腫瘍環境を維持する分子メカニズムはとても複雑です。そのため癌化の分子メカニズムの理解には、解決すべき問題点が多く残っています。現在、一部の遺伝子の変異を持つ癌に対して効果を示す「分子標的薬」が用いられていますが、やがてその分子標的薬に対して耐性を持つ癌細胞が出現します。このことが癌治療をより困難にさせる一因となっています。私たちは、癌治療における様々な問題点を解決すべく、これまで行ってきた癌研究の成果をもとに様々な視点から、癌化の分子メカニズムを解明する研究を行っています。そして血液内科や呼吸器内科といった臨床医学の研究室との共同研究を通して、より良い癌治療法開発のための基盤研究を行っています。
研究テーマ3:Hedgehogシグナル伝達経路の制御メカニズムの解明
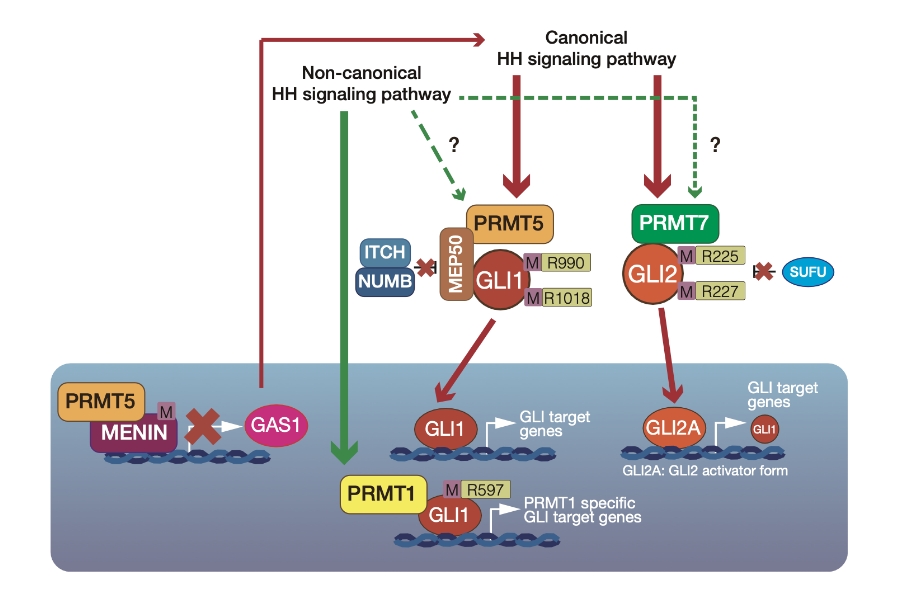
Hedgehogシグナル伝達経路は多くの癌で活性化が報告されています。近年Hedgehogシグナル伝達経路の活性化には、アルギニンメチル基転移酵素(PRMT)ファミリーが深く関与することが明らかになってきました。現在、PRMTファミリーに着目した新たな癌発症の分子メカニズム解明を進め、PRMTファミリーを標的とした、癌治療法開発への展開を目指しています。またHedgehogシグナル伝達経路を標的とした、新たな創薬コンセプトに基づく創薬開発を行っています。私たちはPRMT5がGLI1の安定化し、Hedgehogシグナル伝達経路を活性化に導くことを見出しました。そのほかPRMT1はGLI1標的遺伝子の指向性制御に関与すること、PRMT5はGAS1の転写抑制によってHedgehogシグナル伝達経路を活性化に導くこと、PRMT7はGLI2の転写活性化に関与することが報告されています。
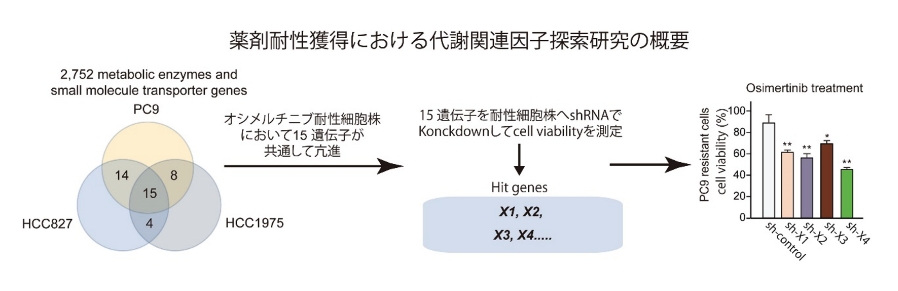
研究テーマ4:分子標的薬耐性獲得メカニズムの解析と耐性化予防戦略
癌の分子標的薬は、標的遺伝子を有する癌には非常に有効である一方で、薬剤耐性を生じてしまうことが問題となっています。私達は、癌細胞の耐性化には細胞内外のストレスに適応する能力の中で、複数の代謝適応を介して悪性化を促進する「代謝リプログラミング」が重要であると考え研究を行っています。これまでに肺癌の分子標的薬耐性株を解析した結果、細胞により種々の代謝経路を介して薬剤耐性を獲得していたことがわかってきました。特に薬剤耐性株では共通した代謝経路を亢進することで抗アポトーシス能を獲得することで耐性の獲得に寄与していることがわかってきました。現在は、糖質、脂質、タンパク質の代謝を包括的に解析すると同時に、代謝制御因子の探索、代謝経路を標的とした薬剤耐性獲得の克服法の開発、栄養状態の制御による耐性化予防という新しい治療戦略の開発を目指しています。